抗菌肽BCp12保鲜膜的制备及其对乳扇保鲜的影响
杨婷婷,杨 婧,袁子又,赵 琼,杨 昆,黄艾祥*
(云南农业大学食品科学技术学院,云南 昆明 650201)
摘 要:为延长乳扇的货架期,以酪蛋白、壳聚糖为原料包裹抗菌肽BCp12来制备复合保鲜膜。以膜的断裂伸长率、拉伸强度、抑菌活性为指标筛选出最佳的制备工艺,利用SEM、FT-IR及分子对接探究复合膜的形成机理,并将其应用于乳扇保鲜。结果表明,可食膜的最佳制备工艺为酪蛋白/壳聚糖比例1:1.5、BCp12 1mg/mL、甘油含量1.5%、干燥温度55 ℃。SEM显示复合膜具有良好的相容性及FT-IR显示该膜中1545.67 cm-1为C-O伸缩振动吸收峰且结构稳定。分子对接表明BCp12与酪蛋白、壳聚糖之间主要通过残基Y4与-NH2活性位点产生氢键相互作用。与对照组相比,该膜能显著延长乳扇的保质期,以期为BCp12/壳聚糖/酪蛋白复合膜的应用开发提供一定的技术参考。
关键词:保鲜膜;抗菌肽BCp12;分子对接;乳扇保鲜
Preparation of Antimicrobial Peptide BCp12 Edible Film and its Effect on the Preservation of Milk Fan
YANG Tingting, YANG Jing, YUAN Ziyou, ZHAO Qiong, YANG Kun, HUANG Aixiang*
(College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China)
Abstract: In order to prolong the shelf life of milk fan, casein and chitosan were used as raw materials to wrap antimicrobial peptide BCp12 to prepare edible film. The optimum preparation process was selected based on the elongation at break, tensile strength and antimicrobial activity of the film. The formation mechanism of the edible film was explored by SEM, FT-IR and molecular docking, and it was applied to the preservation of milk fan. The results showed that the optimum preparation conditions were casein/chitosan ratio 1:1.5, 1 mg/mL of BCp12, 1.5 % of glycerin content (v/v), drying temperature was 55 ℃. The edible film had good compatibility and was C-O stretching vibration absorption peak in 1545.67 cm-1. Molecular docking showed that the hydrogen bond interaction between BCp12 and casein and chitosan mainly occurred through the active site of residues Y4 and -NH2. Compared with the control group, this film can significantly prolong the shelf life of milk fan, in order to provide a certain technical reference for the application and development of BCp12/chitosan/casein edible film.
Keywords: edible film; antimicrobial peptide BCp12; molecular docking; preservation
随着人们生活质量的提高,微生物污染引起的食源性疾病极大的危害了人体健康,防止食品微生物污染已经迫在眉睫。乳品作为人们生活必需品,其中常见的金黄色葡萄球菌和大肠杆菌是国家食品卫生法中强制检测的致病菌[1]。由于可食性包装[2-3]具有对人体无害、抗菌、绿色环保及延长食品货架期等优点,常用来抑制食品中微生物生长。目前,应用最多的天然高分子材料通常是蛋白质类、多糖类及复合类[4]。与普通保鲜膜相比,天然保鲜膜具有保鲜、可食、安全等优点,赋予成膜壁材在食品包装中具有很高的应用价值。壳聚糖是地球上的第二大生物资源多糖,仅次于纤维素,是天然可再生资源[5-6],它具有抗菌性、生物相容性和无毒性等优点,因此可开发成食品包装材料[7-8],是研究和应用最广泛的可食膜之一。壳聚糖常与其他物质复配用于食品保鲜,如番茄[9]、银鲤[10]等,均表现出较好的保鲜效果。酪蛋白具有耐热性、乳化性、溶解性等功能特性,因此它能形成薄膜以阻止食品与外界接触并免受污染[11-12]。但由于酪蛋白自身的亲水性及不具备抗菌性的缺点,膜的性能有待提高。有研究表明,壳聚糖、酪蛋白复配使用可提高蛋白的溶解性及成膜性[13]。然而,抗菌肽是高等真核生物中先天免疫系统的重要部分,一般含有100个以下或有广谱抑菌活性的小分子多肽,其有抗病毒、抗菌甚至抗癌细胞等多种活性功能[14-15]。在前期研究中,Zhao[16]等从槟榔江水牛奶酪蛋白中分离了新型抗菌肽BCp12,该肽序列为YLGYLEQLLRLK,分子量为1508.82 Da,具有低毒性。随后,李钰芳、杨昆等人研究了抗菌肽BCp12对金黄色葡萄球菌和大肠杆菌的抑菌机理[17-18],若能将其用于复合膜的制备,将提高抗菌肽在食品保鲜方面的应用。目前将抗菌肽BCp12、壳聚糖与酪蛋白复配使用,研究其制备工艺及保鲜效果的报道较少。
本文以酪蛋白、壳聚糖和抗菌肽BCp12为原料制备复合膜,研究其机械性能和抑菌效果,同时通过微观结构、分子对接考察了复合膜的相容性及活性位点,并将其应用于乳扇保鲜,为BCp12/壳聚糖/酪蛋白复合膜在食品保鲜方面的应用提供理论依据。
1 材料与方法
1.1 材料、试剂及实验室病原菌
抗菌肽BCp12是贯筋藤蛋白酶酶解槟榔江水牛酪蛋白,发现该序列来源于牛αS1-酪蛋白,属于新型抗菌肽,由安徽国平药业有限公司合成,纯度为95%以上。
金黄色葡萄球菌CICC 10384、大肠杆菌CICC 10003 中国工业菌种保藏中心;乳扇 云南省大理州;酪蛋白酸钠 Solarbio生物科技有限公司;壳聚糖(食品级) 河南双腾实业有限公司。
1.2 仪器与设备
CR-400/410色彩色差仪 深圳大略电子仪器有限公司;HD-3A水分活度测定仪 厦门市弗布斯检测设备有限公司;Nicolet iS10近红外光谱仪 赛默飞世尔科技公司;FlexSEM1000扫描电子显微镜 日本日立高新公司;Haloes Calipe抑菌圈测量仪 西班牙IUL。
1.3 方法
1.3.1 酪蛋白/壳聚糖/BCp12复合膜的制备
1.3.1.1 复合膜的制备工艺
参考文献[19]的方法,称取3.0 g壳聚糖溶于1%冰乙酸中,并加入1.5%甘油,于磁力搅拌器搅拌30 min后制成壳聚糖溶液。接着,配制1%酪蛋白酸钠溶液搅拌30 min使其溶解,将二者混匀并搅拌6 h备用。随后,将1%的BCp12溶液加入到酪蛋白/壳聚糖膜液中于40 ℃水浴加热搅拌6 h,并超声脱气30 min,即得到BCp12/壳聚糖/酪蛋白复合膜液,待溶液均匀后流延成膜,放入烘箱烘干备用。
1.3.1.2 单因素
以酪蛋白/壳聚糖比例、甘油含量、干燥温度为单因素,考察每个单因素对复合膜机械性能的影响,可得最佳工艺参数。以酪蛋白和壳聚糖浓度各20 mg/mL,研究不同的酪蛋白/壳聚糖比例(2:1、1.5:1、1:1、1:1.5和1:2)、甘油含量(0.5%、1.0%、1.5%、2.0%和2.5%)、干燥温度(45 ℃、50 ℃、55 ℃、60 ℃和65 ℃)对复合膜性能的影响。测定每个单因素时,其他因素固定为酪蛋白/壳聚糖比例1:1.5,甘油含量为1.5%,干燥温度为55 ℃。
1.3.1.3 复合膜机械性能测试
参照文献[20],参考GB/T 1040.3-2006《塑料 拉伸性能的测定》中的方法,利用质构仪进行测定。采用厚度测量仪在复合膜上取9个点进行厚度测定,取平均值。
抗拉强度的计算:
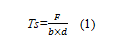
式中:Ts为复合膜的抗拉强度(MPa);F为复合膜断裂时的最大张力(N);b为复合膜宽度(mm);d为复合膜厚度(mm)。
断裂伸长率的计算:
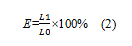
式中:E为复合膜断裂伸长率(%);L为复合膜断裂时的伸长长度(mm);L为复合膜的初始长度(mm)。
1.3.2 复合膜的扫描电镜(SEM)微观形态
将复合膜液的冻干粉在金属样品台上干燥,真空条件下喷金30 min后,将处理好的待测样品于扫描电子显微镜中进行检测,调整工作电压为2.0 kV。
1.3.3 复合膜的红外光谱(FT-IR)
采用傅里叶变换红外光谱仪测定样品,分辨率4 cm-1,扫描范围400-4000 cm-1。
1.3.4 分子对接
使用AutoDock vina 1.1.2软件通过分子对接法分析壳聚糖和酪蛋白的结合方式[21]。酪蛋白和壳聚糖的晶体结构是从结构生物学(RCSB)蛋白质数据库(pdb;https://www.rcsb.org/)中下载的,壳聚糖和酪蛋白的结构用Chemical Bio Drawn Ultra 14.0 软件绘制。从RCSB PDB中得到CSN1S1、CSN1S2、CSN2和CSN3酪蛋白等4种蛋白的x射线晶体结构,保存为pdbqt格式。然后,使用蛋白来计算晶体结构和最低的能量,其将设置成对接的相互作用位点,利用AutoDockTools 1.5.6包生成对接输入文件。挑选出最低结合能的复合物为最有利的结合方式,并采用Pymol 2.3.0将对接结果可视化。
1.3.5 BCp12复合膜液的抑菌实验
参考魏奇[22]等的方法,将大肠杆菌和金黄色葡萄球菌在培养箱中37 ℃培养24 h,无菌去离子水稀释10倍梯度备用。用已灭菌的不锈钢打孔器在平板上打孔,将BCp12不同含量(0.2 mg/mL-1.0 mg/mL)的壳聚糖/酪蛋白膜液向每个孔中加入25 μL。以不含BCp12的膜液作为空白组,实验进行3个平行。观察并统计抑菌圈大小和抑菌圈的直径,评价抗菌性能的效果。
1.3.6 复合膜对乳扇的保鲜作用
1.3.6.1 乳扇的处理
将乳扇样品在无菌操作室里剪成每片质量为1 g且大小为6 cm x 1.5 cm的长方形,覆盖膜后分成对照组、1组(壳聚糖/酪蛋白复合膜)、2组(壳聚糖/酪蛋白复合膜+Nisin)、3组(壳聚糖/酪蛋白复合膜+1 mg/mL BCp12)等四个组,且对照组不做任何处理。将普通薄膜剪成5 cm×5 cm的大小,将处理过的乳扇先用复合膜包裹,再用普通膜覆盖避免污染,置于4 ℃冰箱贮藏。
1.3.6.2 感官评定
将4个处理组的乳扇在明亮宽敞、通风良好、无特殊气味的实验室内,挑选10位评价人员组成评定小组对乳扇成品的色泽、滋味和气味、组织状态进行评分,最终得分为取各项目的平均分,评分标准详见表:
表1 感官评定标准
Table.1 Sensory assessment criteria
分值
色泽
滋味、气味
组织状态
5
乳白色或淡黄色
具有乳扇固有的乳香味
油润光滑、微硬而有韧性
4
乳黄色
具有乳扇固有的乳香味,有轻微酸香味
硬而有韧性
3
乳黄色加深
具有乳扇固有风味,酸味加重
较硬
2
偏黄色
乳扇固有风味淡、酸味较浓
硬度加大
1
黄色
酸味掩盖乳扇固有的乳香味
非常坚硬,剪切费力
1.3.6.3 过氧化值的测定
参考GB 5009.227-2016《食品安全国家标准 食品中过氧化值的测定》进行测定。
1.3.6.4 水分活度(Aw)的测定。
参考GB 5009.238-2016食品中水分活度的测定(第二法),分别称取1.00 g样品置于水分活度仪中,10 min后记录测量值。
1.3.6.5 色差值的测定
采用色彩色差仪测定各处理组乳扇的颜色,使样品与测试端口无缝隙,随机采点进行3次测定,记录样品的L*(亮度)值、b*(黄度)值,取平均值。
1.3.6.6 菌落总数的测定
参考GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》进行测定。
1.4 数据统计与分析
试验重复三次,测定结果取平均值。采用SPSS Statistics 26软件、Origin 8.0软件和Design-Expert 10软件进行统计分析。因素间的显著性通过方差进行分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与讨论
2.1 BCp12/壳聚糖/酪蛋白复合膜的制备
2.1.1 单因素实验结果
2.1.1.1 酪蛋白/壳聚糖比例对复合膜性能的影响
由图1可知,随着壳聚糖含量的增加,复合膜的拉伸强度先增大后减小,当酪蛋白与壳聚糖的比例为1:1时,拉伸强度达到最大值。壳聚糖上的游离氨基和羟基与酪蛋白分子之间存在氢键作用,当用磁力搅拌器充分混合时,二者可在分子水平上产生物理交联,所以复合膜的强度较好[23-24]。酪蛋白与壳聚糖在1:1.5时断裂伸长率最大,但随壳聚糖的增加而降低。这可能是由于壳聚糖浓度过大,二者相容性变差,导致复合膜的拉伸强度和断裂伸长率均下降。因此,选择酪蛋白:壳聚糖1:1.5为最适比例。
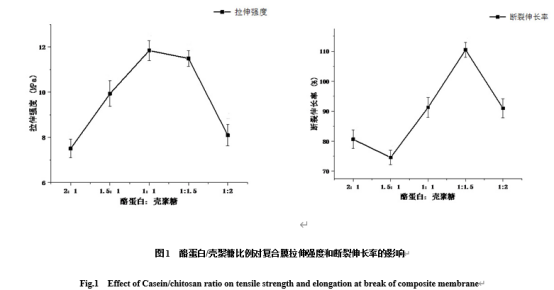
图1 酪蛋白/壳聚糖比例对复合膜拉伸强度和断裂伸长率的影响
Fig.1 Effect of Casein/chitosan ratio on tensile strength and elongation at break of composite membrane
2.1.1.2 甘油含量含量对复合膜性能的影响
甘油可以作为增加复合膜的相容性和可塑性的增塑剂,对提高其力学性能有重要影响[25]。如图2所示,随着甘油含量增大,拉伸强度呈下降趋势,而断裂伸长率呈上升趋势。可能是甘油与酪蛋白和壳聚糖分子之间产生氢键作用并软化了高聚物的刚性结构,使得高聚物链段的流动性增加。但甘油过多会使酪蛋白和壳聚糖的相互作用力减弱,且膜的拉伸强度不佳及力学性能下降。当甘油含量为1.5%时复合膜具有较好的拉伸强度和断裂伸长率。这与张一妹等[26-27]研究结果一致:甘油含量越低,综合性能越好,故选择甘油含量为1.5%。
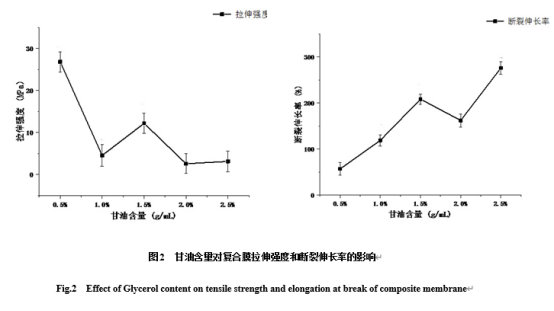
图2 甘油含量对复合膜拉伸强度和断裂伸长率的影响
Fig.2 Effect of Glycerol content on tensile strength and elongation at break of composite membrane
2.1.1.3 干燥温度对复合膜性能的影响
从图3可以看出:拉伸强度和断裂伸长率随着干燥温度的升高呈先升高后降低的趋势,拉伸强度受温度影响较明显,断裂伸长率在55 ℃之前变化缓慢,55 ℃之后迅速下降。当干燥温度上升时,溶剂蒸发留下的空穴过多,造成复合膜的结构缺陷和裂缝,故其拉伸强度和断裂伸长率差,而低温条件下形成的复合膜结构更致密及性能较好。该结果与方健[28]的结果相似,故选择55 ℃为最佳干燥温度。
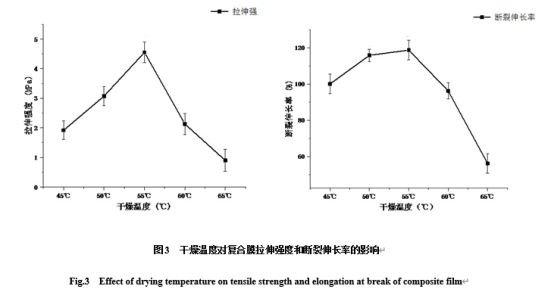
图3 干燥温度对复合膜拉伸强度和断裂伸长率的影响
Fig.3 Effect of drying temperature on tensile strength and elongation at break of composite film
2.2 SEM表征分析
复合膜粉的SEM谱图见图4。复合膜的抗拉强度、断裂伸长率和水蒸气透过系数是由组成膜的大分子决定的。这些大分子成膜时是否均匀或完全溶解将直接影响可食膜的性质。由图4A可知,壳聚糖膜表面光滑致密平整,表明膜内部结构均匀。加入抗菌肽BCp12后,壳聚糖膜表面开始出现孔隙(图4B),这可能是由于BCp12进入壳聚糖内部,冷冻干燥成膜粉后留下的小孔。图4C可见蛋白质颗粒且表面较粗糙,膜中出现孔隙和区块的现象[29],说明BCp12可能负载在复合膜上。这与前面的抗拉强度和断裂伸长率结果结合,可能是由于抗菌肽会使膜内部出现孔隙的原因[30],将导致复合膜的抗拉强度和断裂伸长率下降。与刘敏[31]结果类似,说明BCp12可与酪蛋白、壳聚糖混合使用。

图4 壳聚糖膜(A)、壳聚糖/BCp12复合膜(B)和酪蛋白/壳聚糖/BCp12复合膜液冻干粉(C)的SEM图
Fig.4 SEM images of chitosan membrane(A), chitosan/BCp12 composite membrane(B) and casein/chitosan/BCp12 composite membrane liquid freeze-dried powder(C)
2.3 FT-IR表征分析
从图5可知,BCp12中1656.86 cm-1处是酰胺I带对应的C=O伸缩振动,1440.60 cm-1处是酰胺Ⅱ带,1314.96 cm-1处是酰胺Ⅲ带,1182.63 cm-1对应的是C-O伸缩振动。而BCp12/壳聚糖在1630.05 cm-1处的吸收峰对应于酰胺I带C=O的伸缩振动,1455.10 cm-1处的是酰胺Ⅱ带,1320.93 cm-1处的是酰胺Ⅲ带,1157.75 cm-1对应的是C-O伸缩振动[32]。根据沈亚丽[33]的研究,壳聚糖在3436 cm-1处的峰宽归属于O-H和N-H的伸缩振动重叠峰,1642 cm-1处的吸收峰归属于C=O的伸缩振动(酰胺I带)。而BCp12/壳聚糖的FT-IR图中少了1602 cm-1处的吸收峰,使其峰面积变宽并向低波数移动,说明BCp12/壳聚糖之间存在氢键作用。
BCp12/酪蛋白在1642.15 cm-1处的吸收峰对应的是酰胺I带C=O的伸缩振动,1446.56 cm-1对应的是酰胺Ⅱ带,1314.63 cm-1处的是酰胺Ⅲ带,1172.06 cm-1处的是C-O伸缩振动。根据沈亚丽[33]的研究,壳聚糖在N-H弯曲振动吸收峰为1602 cm-1,BCp12/酪蛋白/壳聚糖复合膜的吸收峰为1545.67 cm-1,由于膜内的氨基发生质子化,形成了NH3+,说明添加BCp12具有更低的波数。BCp12/酪蛋白/壳聚糖复合膜中C-O伸缩振动波数显著性下降并增强,这是由于基团间形成了氢键,使伸缩振动向低波数移动。Huang等[34]利用FT-IR研究了大豆分离蛋白和壳聚糖复合使用时有类似的结论。
与BCp12/酪蛋白膜相比,BCp12/酪蛋白/壳聚糖复合膜的特征峰几乎均向低波数偏移,但未超过BCp12/壳聚糖的特征峰波数。研究表明,若两种水性高分子相容性较好,分子间氢键相互作用会加强,表现为羧基振动峰向低波数方向偏移[35],形成分子内氢键会使吸收强度增加并变宽。因此,可得到BCp12/酪蛋白/壳聚糖复合膜内部存在较强的氢键作用,使之具有良好的相容性,这与张立挺[36]的结果类似。
图5 a、b、c和d分别代表BCp12、BCp12/壳聚糖、BCp12/酪蛋白和BCp12/壳聚糖/酪蛋白复合物的FT-IR图
Fig.5 a, b, c and d represent FT-IR Spectra of BCp12, BCp12/chitosan, BCp12/casein and BCp12/chitosan/casein complexes, respectively
2.4 分子对接
分子对接在结构分子生物学研究中有着广泛的应用,通过计算机模拟等方法可以预测主要蛋白与活性物质间的结合位点及作用方式[37]。由图6可知,CSN1S1、CSN1S2、CSN2和CSN3酪蛋白均能较好的对接于BCp12的活性中心位点,其中,CSN1S1酪蛋白的残基Q112、Y109、K118与BCp12的残基Y1、Y4、Q7、K12之间通过-NH2、-C=O、-OH形成5个氢键,最低结合能-6.3 kcal/mol。与CSN1S1酪蛋白相比,CSN1S2酪蛋白的残基E66、A62与BCp12的残基L2、G3、Y4之间存在3个氢键且长度为3.0 Å。并且CSN2酪蛋白的残基Q138、K128与BCp12残基的L8、L9之间存在2个氢键且结合能为-7.3 kcal/mol。而CSN3酪蛋白残基的G20、P115与BCp12残基的Y1、Y4之间存在2个氢键且结合能为-5.4 kcal/mol。相关研究表明酪蛋白和藏红花素的残基ASN92、PRO57、THR99、ILE45、LYS47之间存在较强的氢键作用,说明酪蛋白和藏红花素结合后结构更稳定[38]。因此,可以推测BCp12的残基Y4和酪蛋白之间通过-NH2形成氢键作用引起复合膜的聚集,使其具有低结合能和稳定性结构[39]。
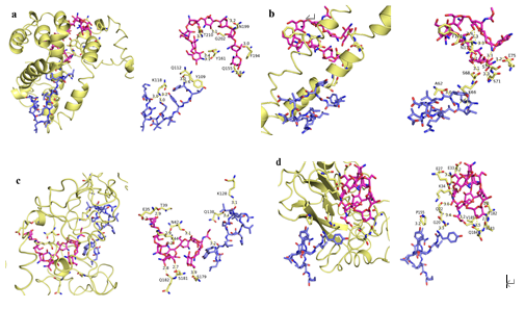



图6 CSN1S1酪蛋白-壳聚糖(a)、CSN1S2酪蛋白-壳聚糖(b)、CSN2酪蛋白-壳聚糖(c)和CSN3-酪蛋白-壳聚糖(d)的分子对接图
Fig.6 Molecular docking diagrams of CSN1S1 casein-chitosan(a), CSN1S2 casein-chitosan(b), CSN2-casein-chitosan(c) and CSN3-casein-chitosan(d)
2.4 BCp12复合膜液的抑菌圈分析
不同浓度的BCp12复合膜液对金黄色葡萄球菌和大肠杆菌的抑菌效果见图7和表2。由表2可知,当BCp12抗菌肽浓度为0.2-1.0 mg/mL时,大肠杆菌的抑菌圈平均大小为0.764 cm,BCp12浓度为0.4 mg/mL时差异显著(P<0.05);当BCp12抗菌肽浓度为1.0 mg/mL时,金黄色葡萄球菌的抑菌圈平均大小为10.26 mm,抑菌效果最好(P<0.05),而大肠杆菌的抑菌圈直径为7.78±0.293。同一条件下,抗菌肽BCp12对金黄色葡萄球菌抑菌效果比大肠杆菌抑菌好,这与赵琼[40]用MIC法研究BCp12对两种致病菌的抑制效果基本一致。而乳扇的食源性致病菌中金黄色葡萄球菌较多,故选1.0 mg/mL为BCp12最佳浓度。
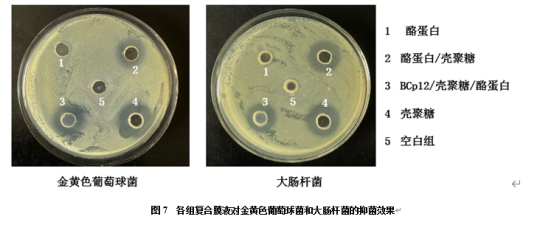
图7 各组复合膜液对金黄色葡萄球菌和大肠杆菌的抑菌效果
Fig.7 The bacteriostatic effect of each group of compound membrane solution on Staphylococcus aureus and Escherichia coli
表2 不同浓度的BCp12的复合膜液对金黄色葡萄球菌和大肠杆菌的抑菌效果
Table.2 The bacteriostatic effect of different concentration of BCp12 compound membrane solution on Staphylococcus aureus and Escherichia coli
BCp12(mg/mL)
抑菌圈大小(mm mg/ml)
金黄色葡萄球菌 CICC 10384
大肠杆菌 CICC 10003
对照
0.2
0.4
0.6
0.8
1.0
8.1±0.305e
8.58±0.323d
9.78±0.368b
8.88±0.334d
9.48±0.357c
10.26±0.386a
7.00±0.262c
7.52±0.283b
7.94±0.299a
7.58±0.285b
7.38±0.278b
7.78±0.293b
注: a-e表示同一列内不同的差异(P<0.05)
2.5 复合膜对乳扇的保鲜研究
2.5.1 感官评价
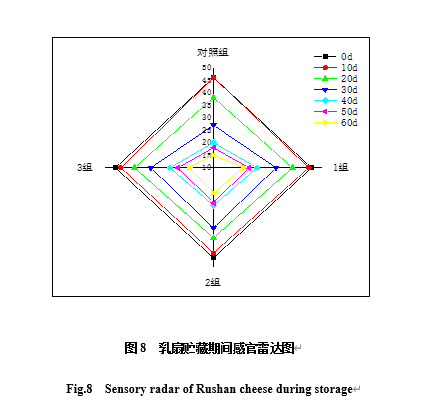
4个处理组的感官评分值在贮藏期内都有所下降,其中对照组的感官评分值下降较快(见图8)。这可能是4 ℃下不能完全抑制微生物生长,且微生物分解的速度足以使乳扇品质下降。1组、2组和3组贮藏60 d的感官评分值变化不大,这是由于乳扇自身的乳酸菌生长代谢、蛋白和脂肪降解使乳扇的酸味、腐败味及酒味加重。根据Pinho[41]等对干酪风味的研究结果,干酪的风味强度随贮藏时间延长而增加。本实验也有类似的现象,由于蛋白质和脂肪的降解使乳扇微观结构中的孔隙增大和持水性下降,将导致乳扇质地变硬[42]。同时,1、2、3组的保鲜效果更好,其可能是壳聚糖、酪蛋白、Nisin和BCp12复合膜可以抑制微生物的生长及蛋白和脂肪的分解,从而延长乳扇的货架期。
2.5.2 过氧化值的变化
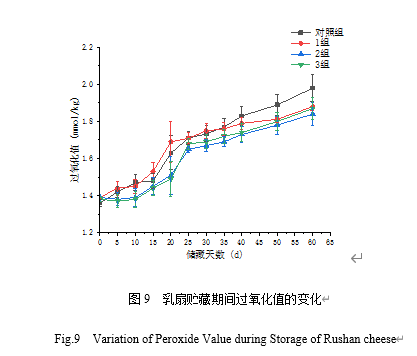
从图9可知,对照组在第20 d时过氧化值为1.61 mmol/kg,BCp12组在第40 d时过氧化值为1.68 mmol/kg,上升趋势比较缓慢。BCp12组在60 d内过氧化值变化不明显,说明BCp12起到较好的抗氧化作用。随着贮藏时间延长,乳扇中过氧化值逐渐增高,从而形成令人不悦的气味,其中对照组的过氧化值均高于实验组。这与苏科巧等[43]研究结果类似,实验组比对照组多一层复合膜的覆盖,使乳扇氧化程度较慢,表明其有一定的抗氧化作用。
2.5.3 色差值的变化
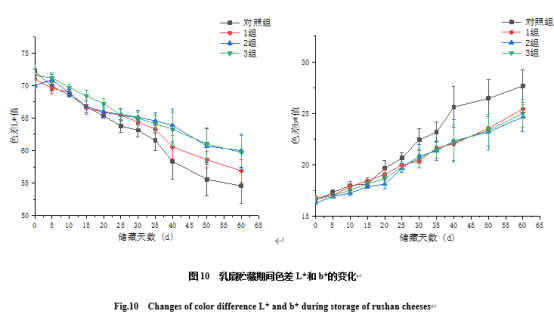
由图10可知,4个处理组的L*值均随贮藏时间的延长呈下降趋势,这是由于脂肪被分解产生游离脂肪酸,蛋白质在酶和微生物的作用下产生氨基酸和小分子肽,与高鹏飞[44]研究结果一致,由于这些油脂蛋白成分的变化会影响光的反射,从而使L*值不断降低。而b*值逐渐升高,使蛋白质变得松软和坍塌,而松散的蛋白骨架无法包埋游离脂肪导致脂肪析出,这与田洋[45]等研究结果一致,乳扇中的蛋白质和脂肪在微生物和内源酶的作用下发生降解,b*值增加。由此可知,BCp12能抑制乳扇中微生物生长并降低蛋白质水解及油脂析出,使乳扇保持一定的亮度值和黄度值。
2.5.4 菌落总数的变化
如表3所示,对照组在前49 d内菌落总数上升,而后呈下降趋势,可能是由于乳扇中酵母菌或乳酸菌大量产酸使pH值下降,不耐酸的细菌大量死亡而造成的。1组、2组和3组都含有壳聚糖且具有抑菌活性,能通过阻止营养物质进入细菌体内或穿过细菌表面进入细胞内部,使细胞正常的代谢活动紊乱,从而抑制细菌生长。2组和3组乳扇贮藏期间菌落总数较1组和对照组少(P<0.05),说明添加BCp12和Nisin能有效抑制微生物繁殖,从而达到较好的抑菌效果。
表3 乳扇贮藏过程中菌落总数变化/CFU·mL-1(×104)
Table.3 Changes of Colony Total in rushan cheese Storage
贮藏时间/d
组别
对照组
1组
2组
3组
7
0.97a
0.08b
0.05c
0.05c
21
4.5a
3.3b
0.695c
0.67c
35
11.5a
6.7b
0.5c
<0.1d
49
21.5a
1.8c
0.45d
10.8b
63
0.22a
0.01b
<0.01c
<0.01c
注: a-d表示同一行内不同的差异(P<0.05)
3 结论
本文筛选了一种具有抗菌及保鲜效果的BCp12复合膜并研究其机制,且添加BCp12可提高复合膜的断裂伸长率和抗拉强度。对于复合膜液的抑菌特性,添加BCp12可显著提高其抑菌效果,当抗菌肽为1 mg/mL时,复合膜液对金黄色葡萄球菌和大肠杆菌的抑菌圈分别为10.26 mm和7.78 mm,对金黄色葡萄球菌抑菌效果最佳。微观结构上,SEM和FT-IR显示复合膜有较好的相容性且未出现分层现象以及分子对接表明BCp12的残基Y4与酪蛋白、壳聚糖之间存在较强的氢键作用。将复合膜用于乳扇保鲜,能更好的延长保质期。这一研究结果可为BCp12/壳聚糖/酪蛋白复合膜用于乳扇保鲜技术的研究奠定理论基础。
参考文献[1] 张曼. 牛乳中金黄色葡萄球菌、大肠杆菌、产气荚膜梭菌多重PCR检测方法的建立及应用[D]. 西北农林科技大学, 2010.
[2] JEON Y J, KAMIL J Y, SHAHIDI F. Chitosan as an edible invisible film for quality preservation of herring and atlantic cod[J]. Journal of Agricultural & Food Chemistry, 2002, 50(18): 5167-5178.
[3] 李慧玲, 徐长妍, 蒋少华. 功能包装材料的发展现状与趋势[J]. 中国材料进展, 2019, 38(12): 1135-1144, 1134.
[4] 曹侃, 王天杰. 可食膜在食品中的应用进展[J]. 武汉轻工大学学报, 2019, 38(1): 22-26, 66.
[5] 赖坤平. 甲壳素和壳聚糖在医药领域的应用[J]. 今日药学, 2009, 19(11): 14-16.
[6] 鲁孝俊. 壳聚糖处理柞蚕丝的染整加工性能研究[D]. 苏州大学, 2007.
[7] 邬思辉. 壳聚糖制备、质量控制及纳米粒负载胰岛素性能研究[D]. 广东药学院, 2009.
[8] PRASHANTH K V H, THARANATHAN R N. Chitin/chitosan: modifications and their unlimited application potential-an overview[J]. Trends in Food Science & Technology, 2007, 18(3): 117-131.
[9] 王刚, 范效琪, 徐亚铭, 等. 壳聚糖用于水果天然保鲜剂的研究田[J]. 现代中药研究与实践, 1992, 4: 35-37.
[10] FAN W, Sun J, Chen Y, et al. Effects of chitosan coating on quality and shelf life of silver carp during frozen storage[J]. Food Chemistry, 2009, 15(1): 66-70.
[11] GOUNGA M E, XU S Y, WANG Z. Whey protein isolate-based edible films as affected by protein concentration, glycerol ratio and pullulan addition in film formation[J]. Journal of Food Engineering, 2007, 83(4): 521-530.
[12] KRISTO E, BILIADERIS C G, ZAMPRAKA A. Water vapour barrier and tensile properties of composite caseinate-pullulan films: Biopolymer composition effects and impact of beeswax lamination[J]. Food Chemistry, 2007, 101(2): 753-764.
[13] 曾丽萍, 樊爱萍, 闫伟. 响应面法优化壳聚糖/酪蛋白酸钠可食性膜的制备工艺[J]. 现代食品, 2021(21): 60-64, 71.
[14] PETERS B M, SHIRTLIFF M E, JABRA-RIZK M A, et al. Antimicrobial Peptides: Primeval Molecul es or Future Drugs?[J]. PLoS Pathogens, 2010, 6(10): 1001067.
[15] PICHU S, RIBEIRO J M C, MATHER T N. Purification and characterization of a novel salivary antimicrobial peptide from the tick, Ixodes scapularis[J]. Biochemical & Biophysical Research Communications, 2009, 390(03): 511-515.
[16] ZHAO Q, SHIY N, WANG X F, et al. Characterization of a novel antimicrobial peptide from buffalo casein hydrolysate based on live bacteria adsorption[J]. Journal of Dairy Science, 2020, 103(12): 11116-11128.
[17] 李钰芳, 杨昆, 顾韦维, 赵琼, 黄艾祥, 施娅楠. 乳源抗菌肽BCp12对金黄色葡萄球菌多靶点抑菌机制[J]. 食品科学, 2021, 42(23): 34-41.
[18] 杨昆, 王欢, 高洁, 李钰芳, 赵琼, 施娅楠, 黄艾祥. 抗菌肽BCp12对大肠杆菌壁膜及DNA损伤的作用机制[J]. 食品科学, 2021, 42(19): 114-121.
[19] 李彤, 张宏, 赵晓彤, 等. 大豆分离蛋白/纳米纤维素/阿魏酸复合膜的制备及其包装性能[J]. 食品科学, 2020, 41(17): 253-260.
[20] BENHABILES M S, SALAH R, LOUNICI H, et al. Antibacterial Activity of Chitin, Chitosan and Its Oligomers Prepared from Shrimp Shell Waste[J]. Food Hydrocolloids, 2012, 29(1): 48-56.
[21] 黄怡, 姚妙恩, 董青青, 等. 基于网络药理学和分子对接研究黄芪-丹参治疗脓毒症的作用机制[J]. 世界临床药物, 2021, 42(5): 11.
[22] 魏奇, 白伟娟, 钟鑫荣, 等. Checkerboard法对ε-聚赖氨酸和壳聚糖抑菌作用的研究[J]. 食品研究与开发, 2021, 42(23): 14-19.
[23] 岳晓华, 沈月新, 寿霞等. 壳聚糖-甲基纤维索复合膜的制作研究与性能测定[J]. 农产品加工, 2005, 3: 28-30.
[24] 岳晓华, 沈月新. 可食性壳聚糖膜性能的研究[J]. 食品科学, 2002 (8): 62-67.
[25] 尹璐, 彭勇, 于华宁. 中心组合试验优化葛根淀粉壳聚糖复合膜性能[J]. 食品科学, 2013, 34(8): 6-11.
[26] 张一妹. 壳聚糖可食膜的制备及其对蓝莓的保鲜作用[D]. 中国海洋大学, 2013.
[27] 汪东风, 张一妹, 徐莹, 等. 壳聚糖复合膜处理对蓝莓保鲜效果的影响[J]. 现代食品科技, 2014, 30(02): 62-65, 41.
[28] 方健. 壳聚糖基膜材料的制备、性能与结构表征[D]. 北京林业大学, 2013.
[29] MIMA S, MIYA M, IWAMOTO R, et al. Highly deacetylated chitin and its properties[J]. Journal of Applied Polymer Sciences, 28(1983): 1909-1917.
[30] ZHANG Z J, LI N, LI H Z, et al. Preparation and characterization of biocomposite chitosan film containing Perilla frutescens (L.) Britt. essential oil[J]. Industrial Crops & Products, 2018, 112: 660-667.
[31] 刘敏, 赵浩, 范贵生, 等. 壳聚糖-酪蛋白酸钠可食性抑菌膜结构表征及抑菌性的研究[J]. 食品研究与开发, 2017, 38(02): 12-16.
[32] HUA W, LOU Y, XU W, et al. Batch affinity adsorption of His-tagged proteins with EDTA-based chitosan[J]. Applied Microbiology & Biotechnology, 2016, 100(2): 879-891.
[33] 沈亚丽. 电荷密度对壳聚糖-酪蛋白复合作用的调控研究[D]. 浙江工商大学, 2018.
[34] HUANG G Q, SUN Y T, XIAO J X, et al. Complex coacervation of soybean protein isolate and chitosan[J]. Food Chemistry, 2012, 135(2): 534-539.
[35] HUANG R Y M, PAL R, MOON G Y. Characteristics of sodiumalginate membranes for the pervaporation dehydration of ethanol-water and isopropanol-water mixtures[J]. Journal of Membrane Science, 1999, 160(1): 101-113.
[36] 张立挺, 蒋子文, 高磊, 等. 壳聚糖明胶可食用复合膜的制备与抗菌性能研究[J]. 食品研究与开发, 2020, 41(06): 106-111, 180.
[37] STRYNADKA N C, EISENSTEIN M, et al. Molecular docking programs successfully Predict the binding of a beta-lactamase inhibitory protein to TEM-1 beta-lactamase[J]. Nature structural biology, 1996, 3: 233-239.
[38] 范浩伟. 藏红花素-酪蛋白纳米复合物理化性质及其对藏红花素生物利用度的影响[D]. 南昌大学, 2021.
[39] YU X, LI J, YANG M , et al. Role of epigallocatechin gallate in collagen hydrogels modification based on physicochemical characterization and molecular docking[J]. Food Chemistry, 2021, 360(3): 130068.
[40] 赵琼, 李素梅, 陈昌航, 等. 贯筋藤蛋白酶水解槟榔江水牛酪蛋白制备抗菌肽[J]. 食品工业, 2020, 41(05): 151-155.
[41] PINHO O, FERREIRA I M P L V O, FERREIRA M. Discriminate analysis of the volatile fraction from‘‘Terrincho’’ ewe cheese: correlation with flavour characteristics[J]. International Dairy Journal, 2004, 14(5): 455-464.
[42] 徐红华, 贺殷媛, 温其标. Gouda干酪在贮藏期蛋白质水解对其质构和微观结构的影响[J]. 中国乳品工业, 2008, 36(3): 11-14.
[43] 苏科巧, 陶亮, 李木桂, 等. 乳扇保鲜技术研究[J]. 中国乳品工业, 2015, 43(1): 21-24.
[44] 高鹏飞. 亚麻籽胶/壳聚糖自组装膜在奶豆腐包装中的应用[D]. 内蒙古农业大学, 2017.
[45] 田洋, 肖蓉, 史崇颖, 等. 真空包装条件下不同水分含量乳扇的品质变化[J]. 中国乳品工业, 2007, 35(1): 23-26.
抗菌肽BCp12保鲜膜的制备及其对乳扇保鲜的影响
(上传时间:2022/4/5 16:55:44 文章来源:云南奶业协会 浏览次数 打印)收藏
电话:0871-3649220 传真:0871-3649220 E-mail:dayp2006@126.com 云南省奶业协会QQ群:51121847 技术支持:昆明网站建设,云南网站建设-四度网络



 您当前位置:
您当前位置: