李永强a,杨士花b,夏晓辉a,李淳a,初雅洁a,黄艾祥a
(云南农业大学 a.食品科技学院;b.外语学院, 昆明 650201)
摘 要:以水牛奶为材料,利用native-PAGE和SDS-PAGE,通过不同温度和加热条件下总乳清蛋白和单体蛋白质量分数的变化,研究水牛奶乳清蛋白的热稳定性。结果表明:水牛奶乳清蛋白在native-PAGE条件下只有b-LG一条条带,在SDS-PAGE条件下得到4条单体乳清蛋白条带;随着提取温度和时间的增加,水牛奶单体乳清蛋白和总乳清蛋白质量分数均呈下降趋势,说明水牛奶乳清蛋白热稳定性较差;4种乳清单体蛋白中,a-LA的热稳定性最好,IG的热稳定性最差,热稳定性顺序为:a-LA>b-LG>BSA>IG。
关键词:水牛奶;乳清蛋白;热稳定性;电泳
Heat stability of whey proteins from buffalo mik
LI Yong-qianga, YANG Shi-huab, XIA Xiao-huia, LI Chuna, CHU Ya-jiea, HUANG Ai-xianga
(Yunnan Agricultural University a.College of Food Science and Technology;
b. College of Foreign Languages, Kunming 650201, China)
Abstract: The heat stability of buffalo milk whey proteins were investigated by means of the changes of total whey proteins and individual whey protein at different heat temperatures and times, using native-PAGE and SDS-PAGE. Results showed only b-LG was found by native-PAGE, but four whey protein bands were found by SDS-PAGE. Individual whey protein and total whey proteins contents were decreased when temperatures and times were increased, indicated buffalo whey proteins had poor heat stability. Among the four individual whey protein, a-LA exhibited the strongest heat-tolerance but IG was opposite. The heat stability order was: a-LA >b-LG >BSA>IG.
Key words:buffalo milk;whey protein;heat stability;electrophoresis
中图分类号:TS252 文献标识码:A 文章编号:
0 引言
水牛奶被誉为“奶中之王”、“乳中珍品”,营养全面。按总的营养物质折算成标准奶,1kg水牛奶相当于荷斯坦牛奶1.85kg [1]。目前,云南省现有的水牛奶加工产品由于保质期较短,很难进入外地市场。超高温瞬时灭菌(UHT)奶具有保质期长,无需冷藏保存等优点,但是在加工过程中,水牛奶蛋白质由于热稳定性较差,容易发生胶凝作用,影响了水牛超高温瞬时灭菌奶的加工,制约了水牛奶产业的进一步发展[2-4]。
水牛奶加热过程中乳清蛋白的变性被认为蛋白质热稳定性较差的主要原因。乳清蛋白主要包括β-乳球蛋白(b-lactoglobulin,b-LG)、a-乳白蛋白(a-lactalbumin,a-LA)、牛血清蛋白(bovine serum albumin,BSA)和免疫球蛋白(immunoglobulin,IG)[5-14]。关于水牛奶乳清蛋白的热稳定性研究鲜有报道,本研究利用非变性native-PAGE电泳和变性SDS-PAGE电泳,研究加热过程中温度和时间对水牛奶乳清蛋白稳定性的影响,旨在为水牛奶超高温瞬时灭菌(UHT)加工过程中解决蛋白质热变性提供理论基础,提高水牛奶产品
的保质期和销售半径,促进云南省水牛奶产业的发展。
1 实验
1.1 材料
水牛奶,4℃冰箱中冷藏备用;b-LG,a-LA,BSA和IG标准品,TEMED;丙烯酰胺,甲叉丙烯酰胺,Tris–HCl,SDS,β-巯基乙醇,考马斯亮蓝R250;甘油,过硫酸铵,甲醇,冰乙酸,盐酸,氢氧化钠等均为分析纯。
1.2 仪器与设备
DYY-6C型电泳仪,DYCZ-24A型电泳槽,WD- 9413A型凝胶成像分析系统。
1.3 方法
1.3.1 乳清蛋白制备
水牛奶在4℃于8500g离心15min,得到脱脂水牛奶,取样品20mL,在50mL具塞试管中于将60,70,80,90℃中分别加热5,10,15,20,25,30 min;然后在冰浴中迅速冷却,用6%冰乙酸调节水牛奶pH值为4.6,在4℃于10000g离心15min,过滤得到上清,即为乳清蛋白。
1.3.2 非变性native-PAGE电泳[15]
非变性native-PAGE电泳凝胶包括10%分离胶和4%浓缩胶。乳清蛋白和3倍体积的非变性缓冲溶液(浓度为0.1mol/L的Tris–HCl,pH值为6.8;体积分数为20%的甘油,质量分数为0.01%溴酚蓝)混合后,用移液器取8μL样品点样进行电泳,用质量浓度为1g/L的R250考马斯亮蓝染色,体积分数为7.5%的甲醇 和体积分数为 7.5% 冰乙酸脱色。标准的蛋白质标样b-LG,a-LA,BSA和IG同时电泳。
1.3.3 变性SDS-PAGE电泳[15]
变性SDS-PAGE电泳凝胶包括质量分数为12.5%分离胶和4%浓缩胶。蛋白质样品和3倍体积的变性缓冲溶液(浓度为0.1mol/L的Tris–HCl,pH值为6.8;体积分数为20%的甘油,体积分数为2%的SDS,体积分数为5%的β-巯基乙醇, 0.01%溴酚蓝)混合后,沸水浴中加热5min,4℃于10000g离心15min,吸取上清8~10μL进行SDS-PAGE电泳。标准的蛋白质标样b-LG、a-LA、BSA和IG同时电泳。
1.3.4 染色
染色液:0.1g考马斯亮蓝(R-250),50 mL乙醇, 10 mL冰乙酸,加水定容至100mL。
取出凝胶,去掉浓缩胶,作好标记,倒入染色液摇床染色过夜。
1.3.5 脱色
脱色液:100 mL甲醇, 100 mL冰乙酸,和800 mL水。
用脱色液脱色1~2d。
1.3.6 凝胶成像
利用凝胶成像系统进行蛋白的定性定量。
2 结果与分析
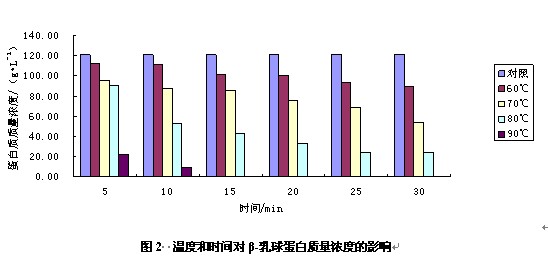
乳清蛋白非变性native-PAGE电泳结果如图1所示。图2为温度和时间对β-乳球蛋白质量浓度的影响。

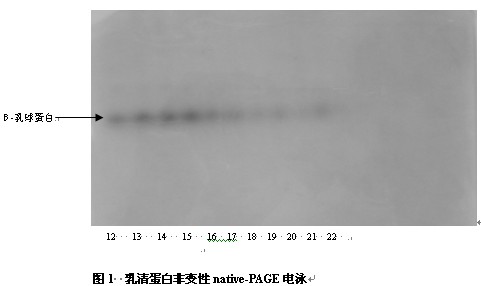
图1中,1为对照;2为60℃,5min;3为60℃,10min;4为60℃,15min;5为60℃,20min;6为60℃,25min;7为60℃,30min;8为70℃,5min;9为70℃,10min;10为70℃,15min;11为70℃,15min;12为70℃,20min;13为70℃,25min;14为70℃,30min;15为80℃,5min;16为80℃,10min;17为80℃,15min;18为80℃,20min;19为80℃,25min;20为80℃,30min;21为90℃,5min;22为90℃,10min。下同。
由图1可以看出,在native-PAGE电泳中,只得到了b-乳球蛋白一条带,可能由于在非变性条件下,水牛奶中其他三种乳清蛋白稳定性较差,b-乳球蛋白稳定性相对较好,电泳时样品中只有b-乳球蛋白。故只对b-乳球蛋白进行分析。
由图1和图2可以看出,在60℃下,随着加热时间的延长β-乳球蛋白的质量浓度从112.16 g•L-1降到89.55 g•L-1,变化并不明显,说明β-乳球蛋白在温度较低时比较稳定;随着温度的增加和加热时间的延长,b-乳球蛋白质量浓度呈明显的下降趋势;在90℃下加热10min后,b-乳球蛋白条带完全消失,说明高温下b-乳球蛋白不稳定,且随加热时间的延长,稳定性下降。
乳清蛋白SDS-PAGE电泳如图3所示。图4为温度和时间对乳清蛋白总量的影响。
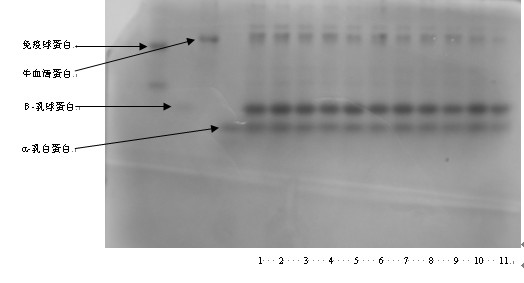
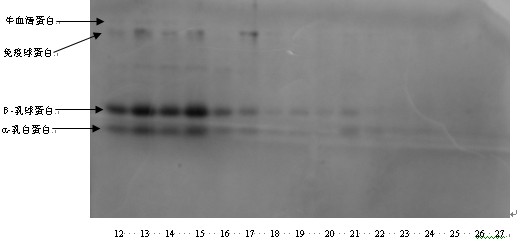
图3 乳清蛋白变性SDS-PAGE电泳
图3中,1~22同上。23为90℃,15min;24为90℃,20min;25为90℃,25min;26为90℃,30min;27为90℃,30min。

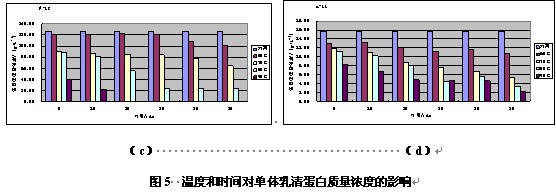
由图5可以看出,随着提取温度和时间的增加,水牛奶单体乳清蛋白质量浓度呈现下降趋势,且均小于空白对照的质量浓度3.20,2.86,126.23,15.74 g•L-1,说明温度对水牛奶各单体乳清蛋白都有影响。
对于IG,温度为80℃和90℃下均没有条带,70℃下加热20min后也没有条带,说明蛋白已经完全分解,说明IG对温度和加热时间十分敏感;对于BSA,90℃下均没有条带,80℃下加热5min后也没有条带,说明BSA对温度和加热时间也比较敏感;对于b-LG,90℃下加热10min后条带消失;a-LA在各种温度下均有条带。说明4种乳清单体蛋白中,a-LA的热稳定性最好,IG的热稳定性最差,热稳定性顺序为:a-LA >b-LG >BSA>IG。
3 结 论
(1)水牛奶乳清蛋白在native-PAGE条件下只有b-LG一条条带,在SDS-PAGE条件下得到4条单体乳清蛋白条带,说明SDS-PAGE较适合研究水牛奶乳清蛋白。
(2)随着提取温度和时间的增加,水牛奶单体乳清蛋白和总乳清蛋白质量浓度均呈下降趋势,说明水牛奶乳清蛋白热稳定性较差。
(3)4种乳清单体蛋白中,a-LA的热稳定性最好,IG的热稳定性最差,热稳定性顺序为:a-LA >b-LG >BSA>IG。
参考文献:
[1] 王雷, 丁春华, 栾爽艳. 我国水牛奶业的发展现状与开发前景[J]. 中国奶牛, 2008(4): 8-11.
[2] 袁跃云,李大林. 云南省奶水牛业2008~201 2年发展规划和2020年远景目标规划研究[J]. 云南畜牧兽医,2008增刊(2):10-18.
[3] 李大林,袁跃云. 云南省奶水牛业发展战略若干问题的思考[J]. 云南畜牧兽医,2008增刊(2):19-21.
[4] 黄艾祥,朱志雄. 云南水牛奶加工业发展初探[J]. 云南畜牧兽医,2008增刊(2):54-56.
[5] RAYNAL-LJUTOVAC K, PARK Y W, GAUCHERON F, et al. Heat Stability and Enzymatic Modifications of Goat and Sheep milk[J]. Small Ruminant Research, 2007, 68: 207–220.
[6] MIRALLES B, BARTOLOME B, RAMOS M, AMIGO L. Determination of Whey Protein to Total Protein Ratio in UHT Milk Using Fourth Derivative Spectroscopy[J]. International Dairy Journal,2000, 10: 191-197.
[7] SHAILESH G A, RAJESH K B, ANIRUDDHA B P. Effect of Agitation on Heat-Induced Deproteination Process of Buffalo Milk Whey[J]. Journal of Food Engineering, 2008, 87: 398–404.
[8] BRISSONA G, BRITTENB M, POULIOT Y. Heat-Induced Aggregation of Bovine Lactoferrin at Neutral pH: Effect of Iron Saturation [J]. International Dairy Journal, 2007, 17: 617-624.
[9] NAYAK S K, MAKRARIYA A, SINGH R R B, PATEL A A, SINDHU J S, PATIL G R, TOMAR P. Heat Stability and Flow Behaviour of Buffalo Milk Added with Corn Starch [J]. Food Hydrocolloids, 2004, 18: 379–386.
[10] NAYAK S K, ARORA S, SINDHU J S, SANGWAN R B. Effect of Chemical Phosphorylation on Solubility of Buffalo Milk Proteins[J]. International Dairy Journal, 2006, 16: 268–273.
[11] ELAGAMY E I. Effect of Heat Treatment on Camel Milk Proteins with Respect to Antimicrobial Factors: a Comparison with Cows’ and Buffalo Milk Proteins[J]. Food Chemistry, 2000, 68: 227–232.
[12] SINGH G, ARORA S, SHARMA G S, SINDHU J S, KANSAL V K, SANGWAN R B. Heat Stability and Calcium Bioavailability of Calcium-Fortified Milk[J]. LWT, 2007, 40: 625–631.
[13] ON-NOM, N, GRANDISON A S, LEWIS M J. Measurement of Ionic Calcium, pH, and Soluble Divalent Cations in Milk at High Temperature[J]. J. Dairy Sci., 2010, 93(2): 515-523.
[14] ALOMIRAH H F, ALLI I. Separation and Characterization of b-Lactoglobulin and a-Lactalbumin from Whey and Whey Protein Preparations[J]. International Dairy Journal, 2004, 14: 411–419.
[15] LIN S J, SUN J, CAO D D, CAO J K, JIANG W B. Distinction of Different Heat-Treated Bovine Milks by Native-PAGE Fingerprinting of Their Whey Proteins [J]. Food Chemistry, 2010, 121: 803–808.
基金项目:云南省教育厅科学研究基金项目(2010Y342),云南省现代农业奶牛产业技术体系项目—乳品加工与质量安全研究
作者简介:李永强(1975—),男,讲师,博士,研究方向为天然产物化学。E-mail:liyongqiang7512@163.com 13987611915
*通讯作者:黄艾祥,博士,教授。